核酸检测实验室想完全杜绝核酸污染是不可能的。核酸检测实验室的管理者和实验人员必须要认识到核酸污染是不可避免的,但是污染的频率和概率是可控的。我们要做的是时刻保持警惕,尽最大努力将污染的概率降到最低,并且能第一时间发现污染并及时进行处理。
当地时间2020年4月18日,《华盛顿邮报》(Washington Post)爆了一则重磅新闻,美国CDC在实验室生产的新冠病毒检测试剂出现了污染问题,导致全美的核酸检测推迟最少一个月。1月21日,CDC已经“确定开发”了新冠病毒的检测方法,并使用它来确认美国的第一例新冠病例,1月下旬,美国CDC对26个公共卫生实验室发放新冠病毒试剂盒,有24个实验室出现了假阳性反应。CDC紧急召回了诊断试剂,直到3月2日,CDC的新冠病毒试剂由Integrated DNA Technologies,IDT公司生产重新投入使用。这起实验室污染的代价是美国错过了黄金的疫情防控窗口,数万甚至数十万普通民众死亡。每一个实验室都应该把这个教训铭记在心,时刻提醒自己,核酸污染随时都可能发生,无论什么级别的实验室都可能发生。较常见,发生概率在40%~60%之间;以重组质粒作为阳性质控品,发生污染的概率更大;以构建的假病毒或重组病毒作为阳性质控品,参与核酸提取的过程中,也容易发生气溶胶污染;在试剂的配制过程中,接触了污染的容器、移液器、枪头、溶液,核酸气溶胶等,导致试剂被污染。笔者认为,这是目前实验室引起的核酸污染最主要原因!
尤其是是第一代PCR技术,发生概率在60%以上;PCR产物经反复多次的扩增,其复制量远远超过PCR的检测极限。
一个气溶胶所包含的拷贝数可以在104~106copies,因此即使是极微量的污染也足以造成实验结果假阳性。
但是,在采用了UNG/UDG防污染的PCR产品中,扩增产物引起的污染概率降至10%左右。
PCR扩增管的密封性是预防扩增产物污染的关键。如果密封不严,扩增完成后有蒸发现象,液面不整齐,或者扩增过程中有“炸管”声音。
放置样品的容器被污染或由于容器密封不严导致样品与外界接触被污染;待提取样本中含有强阳性样本,其提取的样品中含有高浓度的阳性核酸,形成气溶胶造成污染。气溶胶是由空气与液体表面摩擦而产生的。开盖、晃动、加样器的反复抽吸等开放式操作,形成核酸气溶胶从而导致核酸污染。以上核酸污染来源,均可形成气溶胶扩散至空气中,或直接吸附到物体表面。因此,应尤其重视由气溶胶导致污染的问题。重度污染假阳性的ct值可在24左右,中度污染ct值在30左右;轻度污染ct值在33左右。1、空气中的核酸气溶胶污染物:弥散到实验室各个角落,比较棘手;2、物表的核酸污染物:移液器、离心机、核酸提取仪、传递窗、PCR仪、拆开的试剂盒、枪头盒、打开的耗材等表面。
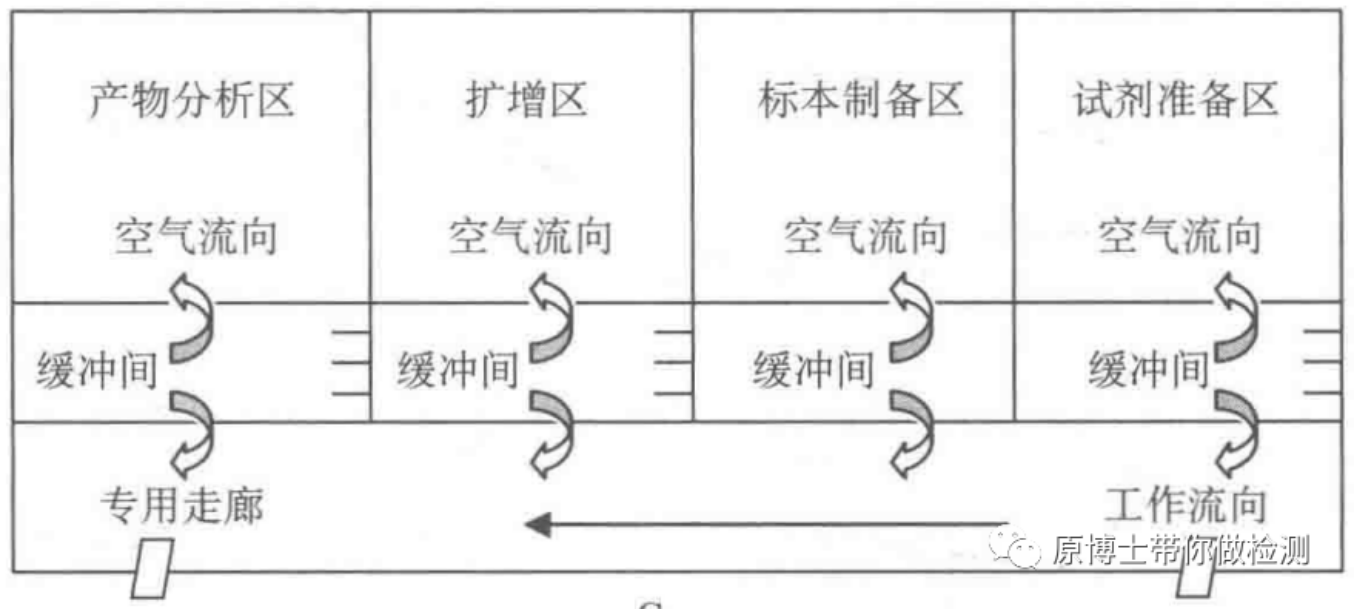
严格的PCR实验室应有标准的正负压系统及四分区(或三分区),实验室应按照生物安全二级实验室及PCR实验室设计基本要求来建设。可参考的标准为《GB50346-2011建设标准生物安全实验室建筑技术规范》及卫健委下发的《医疗机构临床基因扩增检验实验室工作导则》。标准实验室如下图: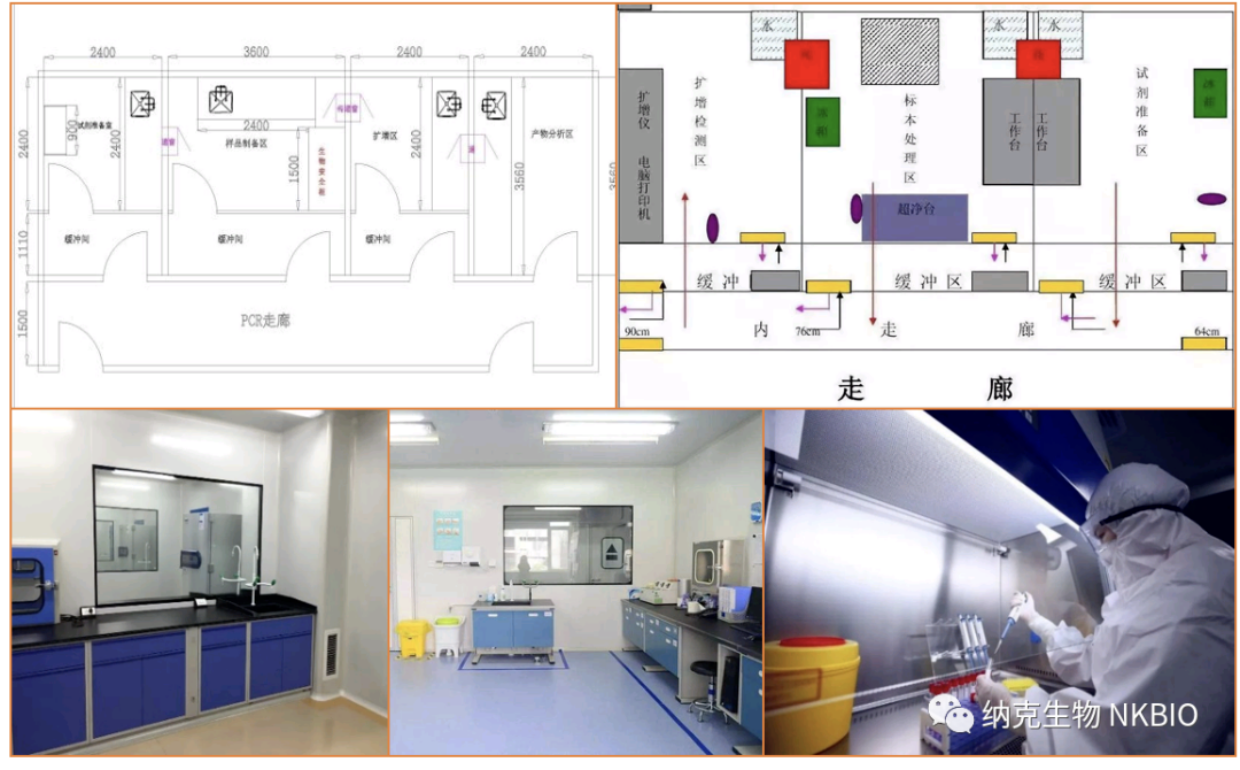
医疗口的实验室大多符合要求,在科研口和农业口的实验室应重视实验室的规范性建设!软件配置应按照卫健委相关技术文件规定,人员配置应专区专人,人员不可不同分区混用,物流、人流、气流做到单向流动!临床上,门诊的新冠快检PCR实验室(或免提取方法)多半不规范。没有严格按照标准PCR实验室建设,更加容易发生污染。三分区(或二分区)、缓冲间、正负压、人员配置2人以上,这些基本要求没有达到,更加容易发生气溶胶污染。现有技术指导原则,只要求了选择BSL-Ⅱ级生物安全柜,但并未规定具体型号。从临床经验来看,只有B2型生物安全柜可以用于加核酸模板。A1型、A2型、B1型,循环风很容易造成核酸气溶胶的形成,从而造成污染,且污染很难清除。B2型为全排放,无循环风,可以用于加核酸模板。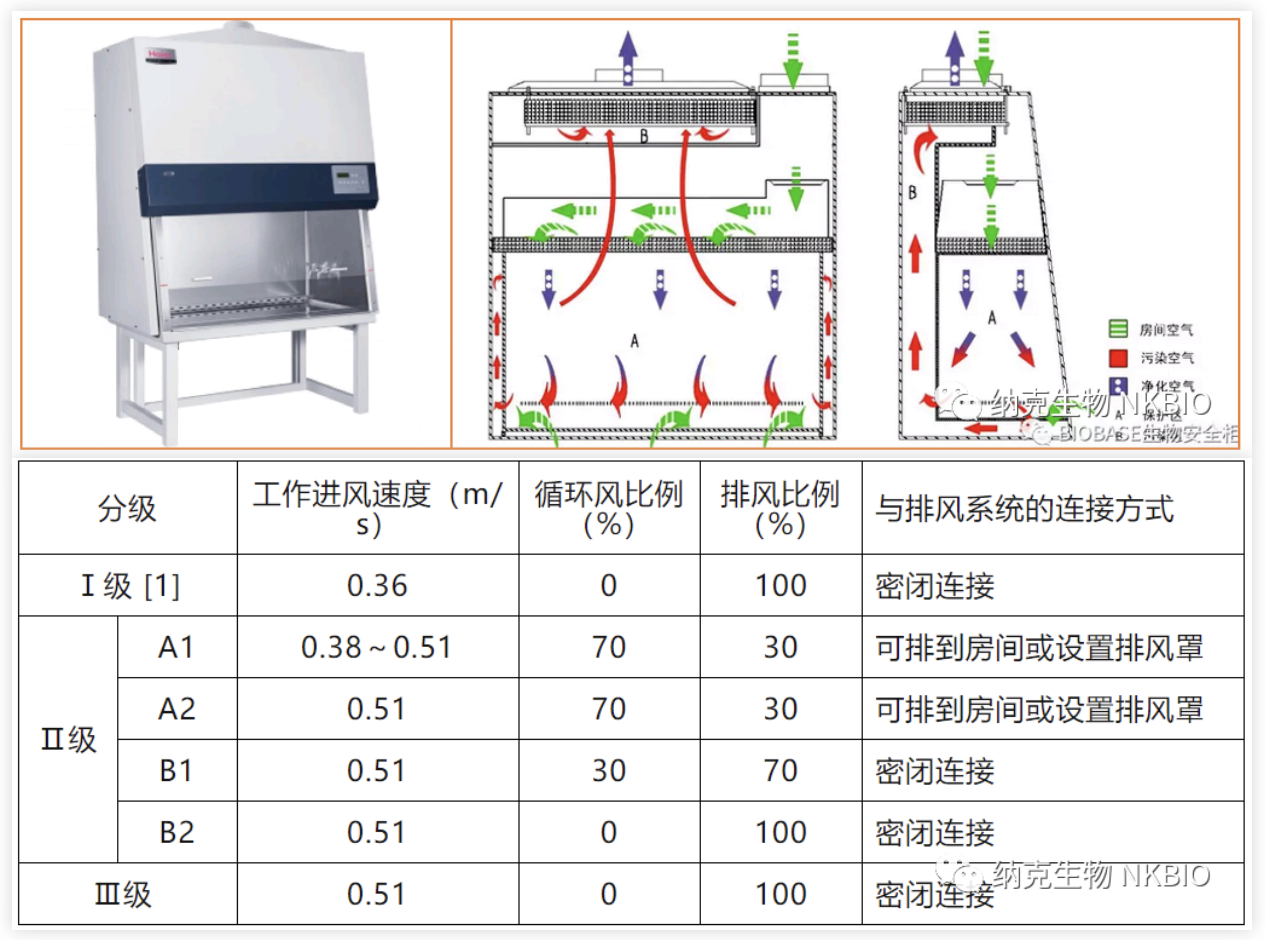
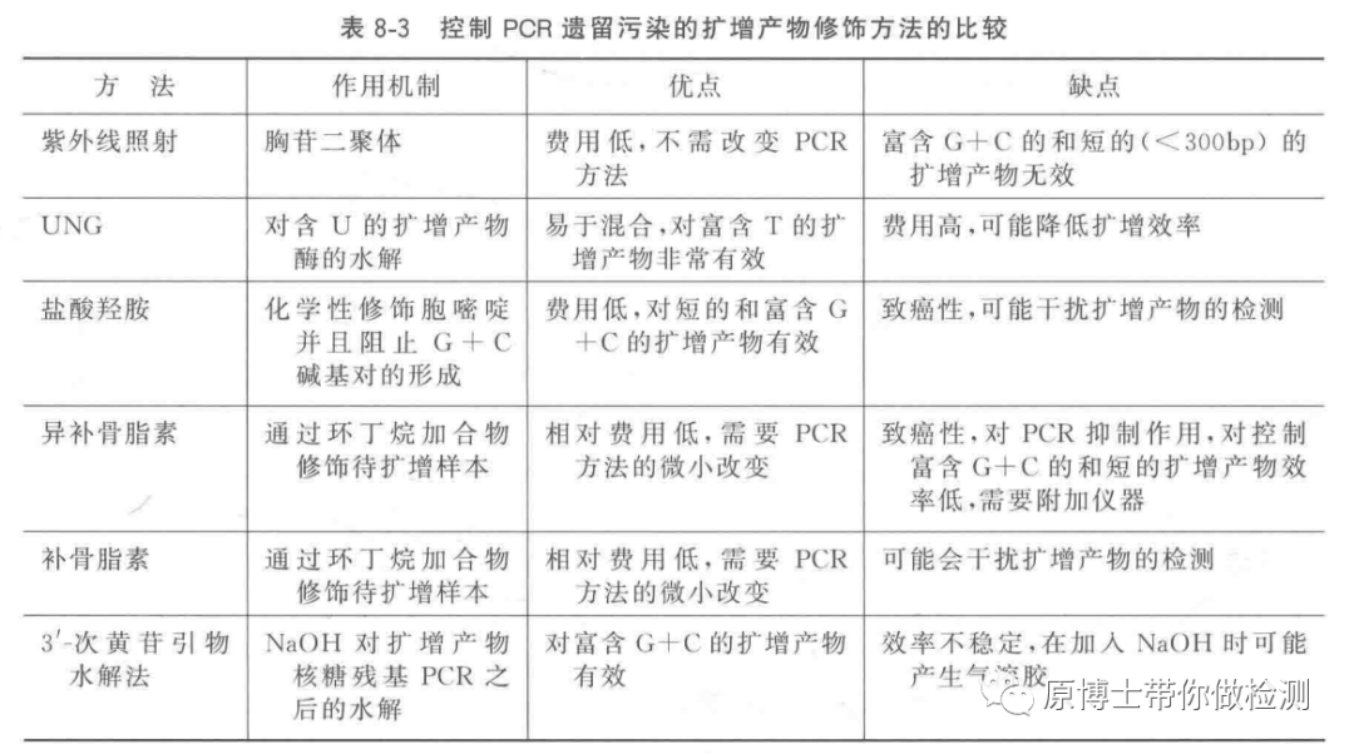
紫外灯能杀灭病毒,但是《医疗机构临床基因扩增检验实验室工作导则》指出,短片段的基因核酸对紫外线损伤不敏感。常规消毒剂如酒精、碘化物、戊二醛类、季铵盐等虽然能杀菌,但是不能降解核酸,或降解效率较差。尤其是酒精,它其实是核酸提取试剂中的一个组分,对核酸没有任何降解作用。已知的消毒剂中,次氯酸盐类消毒剂可以一定程度的降解核酸,但是腐蚀性强,不能处理精密仪器及金属制品,容易腐蚀移液器吸杆影响tip头气密性。
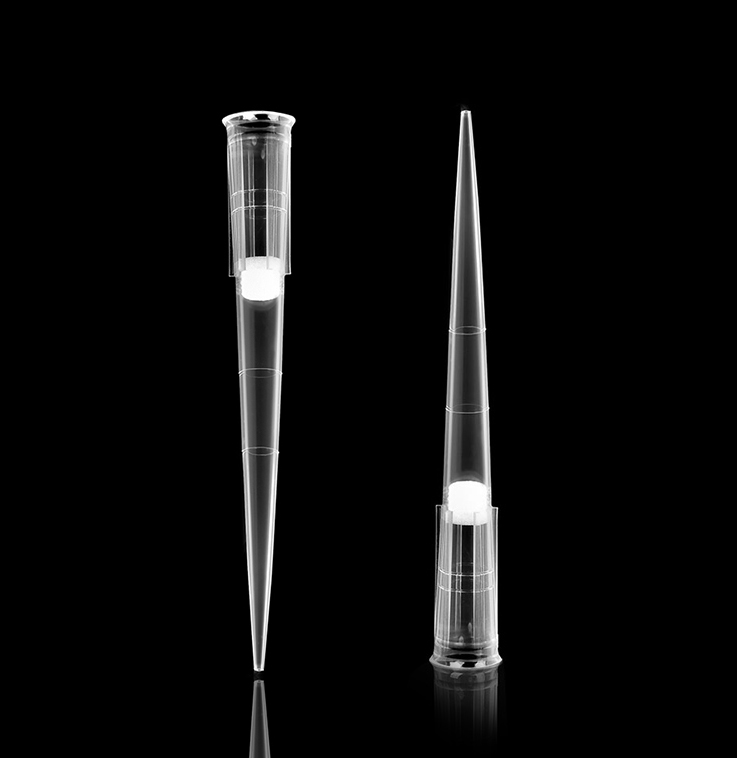
吸取阳性对照(质粒)没有遵循“慢吸快打”的原则(这个需要练习形成“肌肉记忆”),新手往往是“快吸快打”,造成阳性样品污染枪头,或者在生物安全柜循环风的影响下,造成气溶胶飞溅,污染加样区域。应使用带有滤芯的枪头。
带滤芯枪头
4.2 加样区没有放置台面垃圾桶:应把加完样的tip枪头,丢入含有次氯酸溶液的加盖垃圾桶中。因为次氯酸容易挥发,因此应每天都要更换含氯消毒液!
桌面垃圾桶(利器盒)
在笔者的临床实践中,发现以下区域存在阳性污染的概率更大: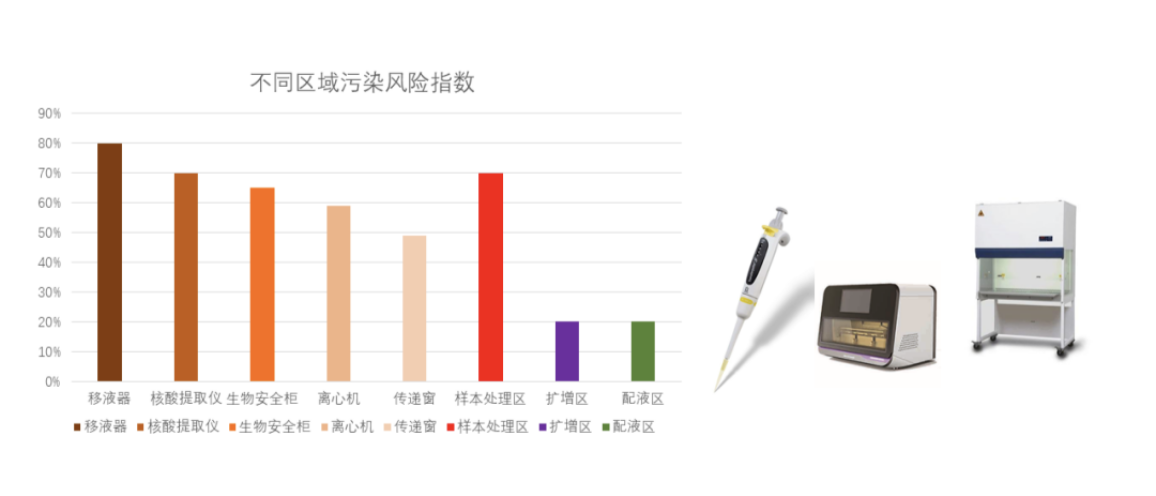
生物安全柜>核酸提取仪>移液器>PCR扩增仪(PCR管密封性)>离心机;阳性质控品>强阳性样本>PCR扩增产物(无UNG技术)>PCR扩增产物(UNG技术),PCR管密封性是扩增产物是否引起污染的关键。如同,幸福的家庭都一样,不幸的家庭各有各的不幸。同理,规范的实验室都一样,污染的实验室各有各染情况。以上数据仅供参考。
核酸检测实验室的布局是预防污染的根本,合理布局可以大大降低污染的概率。一般情况分为四个区分别为试剂准备区,标本制备区、核酸扩增区和产物分析区。对于不需要电泳的荧光定量PCR,核酸扩增区和产物分析区可以合并。每个区应独立通风,可控制空气流动方向。有些核酸检测实验室在实验室建设时未考虑到核酸扩增需求,就是按照普通实验室建设。这种情况下,个人建议扩增和产物分析区应远离试剂准备区和标本制备区,尽量不在一个楼层或者不在一个区域。最忌讳的是几个实验室紧挨着,甚至门对门。另外建议废弃物处理的房间也要远离以上实验室,避免废弃物处理过程中产生的污染。四个隔开的工作区域中每一区域都须有专用的仪器设备。各区域都必须有明确的标记,以避免设备物品如加样器或试剂等从其各自的区域内移出从而造成不同的工作区域间设备物品发生混淆。在不同的工作区域应使用不同颜色或有明显区别标志的工作服,以便于鉴别。进入各个工作区域必须严格遵循单一方向顺序,即只能从试剂贮存和准备区、标本制备区、扩增反应混合物配制和扩增区(简称扩增区)至产物分析区,避免发生交叉污染。再好的实验室设计,如果实验人员不遵守规程,一切都是徒劳的。加强实验室人员的培训和管理至关重要。
阴性质控:实验室的核酸污染风险跟检测量正相关,因此在检测活动比较频繁时需要多添加阴性质控,包括阴性样品,阴性提取对照,阴性扩增对照,无模板对照,甚至可以使用反应体系,引物探针和提取试剂等作为对照以检验检测流程和反应系统组分的污染。阴性对照可以使用几个随机插入检测样品。保证出现污染可以第一时间发现。有一些规范建议PCR产物使用1mol/L盐酸浸泡,我认为这极易造成PCR产物的暴露和扩散,具有很高的风险。还有一些实验室从生物安全的角度将所有的实验废弃物全部高压,我也是不建议的,因为PCR产物没有生物安全风险,高压会造成PCR产物扩散,对实验室的污染风险更高。个人建议对于PCR产物,进行表面消毒后按照普通医疗废弃物处理即可。对于一般的核酸检测实验室,推荐使用封闭扩增的荧光定量PCR方法进行核酸检测。不推荐使用普通PCR方法和巢氏PCR,使用这两种方法实验室污染是大概率事件。谨慎使用等温扩增的方法,等温扩增的酶反应效率更高,产物中模板含量也更高,污染的概率也会提高。操作核酸时动作要轻柔,移液器吸液慢吸慢放,开管盖要慢慢开,避免操作产生气溶胶。使用涡动混匀后,稍稍静置一会再开管盖,推荐使用移液器缓慢吹吸混匀。其原理是用dUTP 代替dTTP,使产物中掺入大量dU。在再次进行PCR 扩增前,用UNG 处理PCR 混合液即可消除PCR 产物的残留污染。由于UNG 在PCR 循环中的变性一步便可被灭活,因此不会影响含dU 的新的PCR 产物。所有试验物品尽可能分装成小包装:耗材开包后分装成一周使用量,用自封袋封好。试剂也尽可能购买小包装或者回实验室分装,实验中经常用到配液的水尤其需要分装。实验中所有吸头都应使用带滤芯的吸头。
发现污染第一步就是要暂停实验,评估假阳性对以往检测结果的影响。对实验进行彻底打扫和清理,尽可能更换相关的试剂耗材,对仪器设备进行清洁和去核酸处理。所有人员回家洗澡换衣服。
使用商品化的DNA去除剂,有好用的DNA去除剂大家可以推荐给我1 mol/l的 盐酸和各种化学物质去降解DNA。停下所有实验,靠风和时间抹掉核酸的痕迹。这是我最常用的方法,通风是最有效的方式。如果是扩增产物污染,在不去除污染的情况下仍然可以进行检测。方法是使用另一种方法或试剂盒,只要两种试剂的扩增产物不一致,没有交叉反应,仍然可以继续试验。但是这种方法要进行测试,我并不推荐这么做。移液器内部被污染很难去除,可以通过清洗或者另换一套移液器。移除内部所有物品,用DNA去除剂擦拭表面后,打开柜门连续运行。用DNA去除剂擦拭内表面后,打开提取仪门或外罩,静置。如果能及时发现污染,通常情况不会太严重,采取上述措施实验室空置几天污染会消除。但是如果发生了很严重的污染,采取上述措施污染仍不能消除,就只能把一切交给时间了。